ANTIDOPING CENTER
Инсулин. Часть II.
Влияние на обмен углеводов.
Действие на обмен глюкозы в печени. Печень - это один из наиболее важных органов тела, запасающих глюкозу. Глюкоза может свободно диффундировать в клетки печени и выходить из них, когда её содержание в крови снижается. В клетках печени глюкоза под влиянием инсулина превращается в гликоген, и её содержание в кови снижается. Один из главных эффектов инсулина состоит в активации фермента глюкокиназы, катализирующей фосфорилирование глюкозы, которая поступает в клетки печени. Инсулин активирует и другие ферменты, в том числе фосфофруктокиназу и гликогенсинтазу, катализирующую полимеризацию фосфорилированной глюкозы в гликоген. Наконец инсулин ингибирует ферменты, расщепляющие гликоген (фосфорилазы), благодаря чему высокий уровень инсулина способствует консервации гликогена. Следует также отметить и тот факт, что инсулин ингибирует глюконеогенез (синтез глюкозы из преимущественно аминокислот) в печени. Это происходит за счёт ингибирования ряда ферментов и за счёт повышения уровня внутриклеточного регулятора фруктозо-2,6-бисфосфата.
За счёт быстрого синтеза гликогена и подавления гликогенолиза концентрация глюкозы в крови, повышающаяся после приёма пищи, быстро возвращается к нормальному уровню. В результате устраняется основной стимул секреции инсулина, и содержание последнего в крови также нормализуется.
Когда организму требуется энергия в промежутках между приёмами пищи, гликоген опять превращается в глюкозу. Концентрация инсулина в крови в этот период очень мала, поэтому фосфорилаза находится в активном состоянии и превращает гликоген в глюкозофосфат, который дефосфорилируется глюкозофосфатазой. Образующаяся при этом глюкоза может свободно выходить из клетки путём диффузии. Таким образом поддерживается постоянный уровень глюкозы в крови между приёмами пищи. При нормальном питании около 60% глюкозы, потребляемой человеком с пищей, временно запасается в печени, с тем, чтобы быстро высвобождаться за счёт расщепления гликогена.
Действие на обмен глюкозы в мышечных клетках. При низкомсодержании инсулина в крови мышечные клетки в норме не проницаемы для глюкозы и всю необходимую энергию получают за счёт окисления жирных кислот. Увеличение концентрации инсулина, вызванное повышением уровня глюкозы в крови после приема пищи, делает мышечные клетки проницаемыми для глюкозы, через увеличение GLUT-4 (GLUT - GLUcose Transporter - переносчик для глюкозы, встроенный в мембрану клетки), которая используется затем в качестве источника энергии. Однако при очень высокой мышечной активности (тренировка) мембраны клеток становятся проницаемыми для глюкозы и в отсутствии инсулина. В этом случае потребность работающей мышцы в глюкозе как энергетическом субстрате удовлетворяется даже при базальном уровне инсулина. Детально этот механизм ещё не изучен. Когда мышца находится в неактивном состоянии, в ней сразу после приёма пищи, т. е. при высоких концентрациях инсулина и глюкозы, тоже образуется и сохраняется небольшое количество гликогена. При острой необходимости этот гликоген опять превращается в глюкозу, которая используется мышечными клетками. Как правило, глюкоза не выделяется обратно в кровь и не играет никакой роли в регуляции уровня сахара в крови после приёма пищи.
Обмен глюкозы в нервных клетках. Клетки ЦНС свою довльно высокую потребность в энергии почти целиком покрывают за счёт глюкозы, причём её потребление не зависит от инсулина. Он не влияет на проницаемость мембран для глюкозы и не активирует ферментные системы этих клеток. Тот факт, что ЦНС получает необходимую ей энергию только за счёт окисления глюкозы, позваляет понять, почему снижение концентрации последней в крови ниже критического уровня (0,5-0,2 г/л) может привести к гипогликемическому шоку с помутнением сознания или даже комой. Большинство других клеток тела отвечает на инсулин подобно мышечным клеткам.
Важно отметить ещё и следующий факт. В клетках инсулинчувствительных тканей инсулин стимулирует протекание реакций пентозофосфатного пути, что в конечном итоге способствует пролиферации (росту и размножению) клеток.
Теперь посмотрите на эту схемку. Ничего особенного в ней нет, за исключением того, что про неё редко кто вспоминает, а зря. Здесь показано как превращается (в норме) поступившая глюкоза в организме человека под действием инсулина.
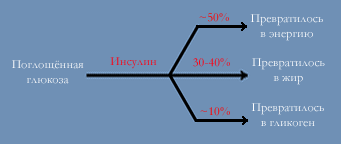 |
Влияние на жировой обмен.
Печень может запасать под действием инсулина лишь ограниченное количество гликогена. Излишки поступившей в печень глюкозы подвергаются фосфорилированию и таким путём удерживаются в клетке, но затем превращаются не в гликоген, а в жир. Это превращение в жир также является результатом прямого действия инсулина, а образующиеся при этом жирные кислоты транспортируются кровью в жировую ткань, где они поглащаются клетками, в которых и хранятся. В крови жиры находятся в составе липопротеинов, играющих важную роль в развитии атеросклероза и связанного с ним риска эмболии и инфаркта.
Действие инсулина клетки жировой ткани в принципе сходно с его действием на клетки печени, однако в печени образование жирных кислот идёт более интенсивно, поэтому они переносятся из неё в жировую ткань описанным выше путём. В клетках жирные кислоты хранятся в форме триглицеридов.
Под действием инсулина распад триглицеридов в жировой ткани снижается, за счёт игибирования гормон-чувствительной липазы. Также инсулин активирует синтез жирных кислот жировыми клетками и участвует в обеспечении их глицеролом, необходимым для синтеза триглицеридов. Всё это в конечном итоге способствут накоплению жира.
Описанное выше влияние инсулина на жировой обмен обратимо, и при низкой его концентрации триглицериды опять расщепляются на глицерол и жирные кислоты. Связано это с тем, что инсулин ингибирует чувствительную к гормонам липазу и при снижении его концентрации липолиз активируется. Свободные жирные кислоты, образующиеся при гидролизе триглицеридов, поступают одновременно в кровь и используются в качестве источника энергии в других тканях. Окисление свободных жирных кислот возможно во всех клетках тела, кроме нервных. Большая часть жирных кислот, освобождающихся при недостатке инсулина из жировых депо, опять поглощается печенью. Клетки печени способны синтезировать триглицериды даже в отсутствии инсулина, поэтому при его недостатке освобождающиеся из депо жирные кислоты накапливаются в печени в виде триглицеридов. Именно по этой причине у больных с дефицитом инсулина, т. е. при сахарном диабете, несмотря на общее похудание, развивается ожирение печени.
Высокое содержание в печени жирных кислот приводит к образованию активированной уксусной кислоты (ацетил-КоА). Поскольку печень не может использовать весь ацетил-КоА в качестве источника энергии, он превращается в ацетоуксусную кислоту, которая выделяется в кровь. При достаточно высокой концентрации инсулина периферические клетки способны превращать ацетоуксусныю кислоту опять в ацетил-КоА, который служит им источником энергии. Но в отсутствии инсулина этого превращения не происходит, и некоторая часть ацетоуксусной кислоты превращается в В-гидроксимаслянную кислоту и ацетон. Эти три метаболита называются кетоновыми телами, а возникающие при этом нарушения обмена - кетозом. Вследствие кетоза у больного в состоянии диабетической комы выдыхаемый воздух пахнет ацетоном, а анализ крови выявляет метаболический ацидоз.
Влияние на белковый обмен.
Получаемые с пищей белки расщепляются до аминокислот, котрые служат затем субстратом для синтеза собственных белков тела. Этот процесс протекает оптимально только при условии действия инсулина. Инсулин обеспечивает активный транспорт в клетки многих, хотя и не всех, аминокислот. Сходным действием обладает гормон роста, но он активирует поглощение других групп аминокислот. Повышение концентрации аминокислот в клетках после приёма пищи приводит к стимуляции синтеза белка на рибосомах. Инсулин стимулирует синтез белка и косвенным путём, повышая скорость транскрипции ДНК в ядре и тем самым образование РНК. В сумме все эти эффекты инсулина способствуют синтезу белка. В последнее время также установлен его антикатаболический эффект. Соответственно отсутствие инсулина даёт противоположный эффект и приводит к истощению белковых ресурсов организма. В этом случае аминокислоты используются либо непосредственно в качестве энергетического субстрата, либо в процессе глюконеогенеза. Поскольку для синтеза белка инсулин имеет почти такое же важное значение, как гормон роста, человек может нормально расти только при оптимальном соотношении обоих гормонов.
Влияние на пролиферацию клеток.
Инсулин стимулирует пролиферацию ряда клеток в культуре. Возможно он участвует и в регуляции роста in vivo. В таких клетках инсулин усиливает способность факторов роста, ПГF2, вазопрессина и аналогов cAMP активировать размножение клеток. Инсулин поддерживает рост и репликацию многих клеток эпителиального происхождения, в том числе гепатоцитов, клеток гепатомы, клеток опухоли коры надпочечников и клеток карциномы молочной железы. Биохимический механизм влияния инсулина на репликацию клеток не выяснен, но предполагают, что он основан на анаболическом действии гормона. Возможно, здесь играет роль влияние на поглощение глюкозы, фосфата, нейтральных аминокислот и катионов. Гормон может стимулировать репликацию, используя свою способность активировать или инактивировать ферменты путём регуляции скорости и степени фосфорилирования белков или регулируя синтез ферментов.
Инсулиновый рецептор, как и рецептор многих факторов роста, обладает тирозинкиназной активностью. Помните, несколько выше я писал об этом. Дело в том, что по крайней мере 10 онкогенных продуктов (многие из которых, вероятно участвуют в стимулировании репликации злокачественных клеток) также представляют собой тирозинкиназы. Клетки млекопитающих содержат аналоги этих онкогенов - протоонкогены. Поясню проще - есть все основания предполагать, что инсулин стимулирут пролиферацию раковых клеток, и, возможно, в высоких дозах выступает в качестве проонкогена. Часть I. Часть III.